1)歯胚の発生
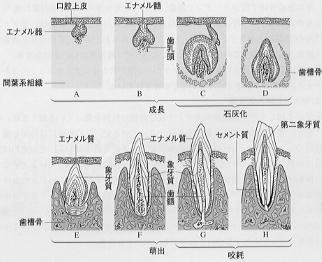
ヒト胎児が妊娠6週目に達すると、口腔に相当する部位の上皮が肥厚して歯堤となる(図4)。次いで、上下の歯堤には乳歯の原基となる10個の歯胚が発生する。
、その後、永久歯となる代生歯の歯胚が各乳歯歯胚の舌側に発生する。歯胚は蕾形から帽子形を経て鐘状となり、その内部に歯乳頭が生じるが、これが、後に歯髄となる。歯乳頭に面する凹んだ内層は内エナメル上皮を形成する。
、一方、象牙質は歯胚の内側に、エナメル質は歯胚の外側に発生する。したがって象牙質とエナメル質は歯冠の先から歯胚を境にして反対方向に成長していく、すなわち象牙質は内側に、エナメル質は外側に向かって延びていくとともに歯根の方向に長さを増していく。
歯は最初は顎の骨の中に埋まっているが、発生段階が進むにつれて歯肉の粘膜を破って萌出する。
2)象牙質の形成
内エナメル上皮は歯乳頭の外胚葉性間葉細胞との相互作用により、歯乳頭の表層の細胞を象牙芽細胞に分化させる。この細胞によって、有機性高分子基質、すなわちⅠ型コラーゲンやプロテオグリカンなどが産生される。
、形成された当初の基質は石灰化されておらず、幅の狭い前象牙質となる。次いで、基質の中に基質小胞を介してヒドロキシアパタイトが析出し、層状に象牙質が形成される。
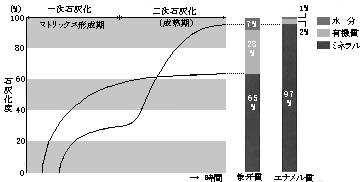 象牙質の石灰化はエナメル質の石灰化とは異なり、1段階で起こり、その石灰化度は60~70%に止まる(*7)(図5)。
象牙質の石灰化はエナメル質の石灰化とは異なり、1段階で起こり、その石灰化度は60~70%に止まる(*7)(図5)。
、しかし、いったん形成された象牙質は、歯牙交換期における乳歯根の吸収の際を除いて、骨のように常に骨吸収が起こることはない。
、象牙芽細胞による象牙質の形成は、前エナメル質を形成するエナメル芽細胞への誘導に先行して起こる。
3)エナメル質の形成
分化した象牙芽細胞によって産生された薄層の象牙質をベースにして、内エナメル上皮からエナメル質を形成する円柱形の分泌細胞であるエナメル芽細胞が分化する。エナメル芽細胞は膜から後退しつつ石灰化してエナメル小柱を形成するアメロジェニンおよびエナメリンを産生・分泌する。
、形成された基質はただちに石灰化する。当初の石灰化度は象牙質の石灰化度よりも低いが、次に蛋白成分の急激な減少と二次的な石灰化度の上昇を来し、ついには、その石灰化度は97%にも達する。したがってエナメル質の形成はマトリックス形成期と成熟期の2段階で起こる(*7)(図5)。エナメル質の石灰化には基質小胞は関与していない。
4)セメント質の形成
内エナメル上皮は象牙芽細胞の分化を誘導するが、中間層を欠くためにそれ自身をエナメル芽細胞に分化させることができないので、歯根部にはエナメル質は形成されない。
、外エナメル上皮が崩壊すると、それが接していた歯根の象牙質の表面で外側の細胞がセメント芽細胞に分化し、セメント質が形成される。
、セメント芽細胞は歯根象牙質の表面に配列し基質の薄い層を形成する。この層にヒドロキシアパタイト結晶が沈着することによりセメント質の石灰化が進行する。
5)歯の形成を調節する遺伝子群
歯の形成を制御する遺伝子群については長らくの間不明であった。ところで胚の背腹軸がどのようにして決定されるかどうかという問題に関して Nusslein-Volhard が1978年にショウジョウバエの幼虫で腹側にできる器官を欠き、からだ全体が背側化されている突然変異体、dorsal を発見し、この現象を解析した結果、正常な胚の細胞質には、dorsal蛋白質が含まれており、この蛋白質の濃度が高い方が腹側になり、低い方が背側になると解釈しうることがわかった。
さらに胚の前後(頭尾)軸の決定機構の研究から発展して、体節決定遺伝子によってつくられる蛋白質の作用でスイッチをオンオフされる一群の遺伝子(ホメオテイック遺伝子)が存在することが明らかになった。さらにすべてのホメオテイック遺伝子に共通な情報を記したホメオボックスがDNAに存在することもわかった。
また、最初にショウジョウバエの体節極性遺伝子としてみいだされ、Nusslein-Volhard および Wieschaus のノーベル賞受賞対象となったヘッジホッグ遺伝子(*8)とよく似た塩基配列をもつDNA断片をマウスで探索したところ、3種のDNA断片がみつかり、それぞれデザート・ヘッジホッグ、インディアン・ヘッジホッグおよびソニック・ヘッジホッグ( Shh )と名づけられた。
最近、ショウジョウバエの Msh 様ホメオボックス遺伝子である Msx-1 や Msx-2 が歯の発生に関与していること(*9)、さらに Shh は一種の仲介役蛋白質である骨形成蛋白質( bone morphogenetic prorein : BMP )群の一つである BMP-2 遺伝子を特定の部位で活性化することが示された。
、さらに BMP は胚の種々の組織間の誘導シグナルとして作用すること、またホメオボックス遺伝子を含む各種転写因子の発現を制御することも明らかとなったが、そのうち、 BMP-2 および BMP-4 が歯の発生における上皮誘導シグナルとして作動していることがわかった(*10)。
、これらの BMPが初期エナメル上皮において産生され、 Msx-1 や Msx-2 の発現をはじめとして、歯の間葉組織の特異的な遺伝子発現の制御に重要な役割を演じていると思われる。
、また TGF-β、FGF および EGF とそれらの受容体も、歯をはじめとして種々の組織の間葉系凝集体の形成および上皮の形態形成に関与していることも明らかとなった。
一方、マウスの歯の形成における上皮・間葉系の相互作用により Notch-1,-2,-3 など Notch 遺伝子の発現が制御されており、エナメル芽細胞の運命の決定にも関与している(*11)。さらに Midkine ( MK )も歯の発生過程の上皮・間葉系相互作用により調節されている(*12)。また、歯冠の先端の形成には FGF-4 が関与していることも示された。
6)石灰化機構
歯や骨にリン酸カルシウムが沈着することを石灰化というが、この機構に関する研究の歴史を繙いてみると、まず1923年に提唱された Robison のアルカリホスファターゼによる Booster 説に端を発し、次いで Neuman の Epitaxy 説、その後、1960年代の基質小胞説へと変遷を遂げている。基質小胞には Booster 説と Epitaxy 説の両者の成立に必要な条件が整っているので、最近では基質小胞の役割が重視されている。
基質小胞は骨端軟骨で最初にみいだされたが、象牙質やセメント質にも存在する。この小胞の直径は30~300nm であり電子密度が高い。この小胞の二重膜にはアルカリホスファターゼ、ピロホスファターゼや ATPase などが含まれており、小胞内でリン酸カルシウムの結晶が成長し、石灰化の核になると考えられる。
、石灰化開始部位に存在する基質小胞中には不定形のリン酸カルシウムが存在し、その Ca/P 比は
0.8~1.0であるが、石灰化が進むにつれて小胞内の Ca/P 比が増大し、ヒドロキシアパタイトの結晶構造物が膜外に突き出てくる。かくしてついには石灰化度の高い象牙質が形成されるに至る。
参考文献
| (*1) | BEC Nordin : Calcium,Phosphate and Magnesium Metabolis,Clinical Physiology and Diagnostic Procedues,Churchill Livingstone (Edinburgh),1976 | (*2) | BL Oser : Hawk's Physiological Chemistry,(McGraw-Hill),New York,1965 | (*3) | 藤田恒太郎 : 歯の話,岩波新書,1965 | (*4) | AR TenCral : Oral Histology,Development, Structure and Function,3rd.,The C.V.Mosby & Co. (St.Louis),1989 | (*5) | GH Sperber : Craniofacial Embryology,4th Ed., Wright (London),1989 | (*6) | W Bloom. DW Fawcett : A Textbook of Histology, 10th Ed., Saunders Co.,1975 | (*7) | SN Bhasker : Orban's Oral Histology and Embryology, 8th Ed., The C.V.Mosby & Co., (St.louis),1976 | (*8) | CNussiein-Volhard, E Wieschaus : Multations affecting number and polarity in Drosophila Nature 287:795-801,1980 | (*9) | l Tthesleff : Homeobox genes and growth tactors in regulation of craniofacial and tooth morphogenesis. Acta Odontol Scand 53:129-134,1995 | (*10) | S Vainio, l karavanova, A Jewett, l Thesleff : ldentification of BMP-4 as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development. Cell 75:45-58,1993 | (*11) | TA Mitsiadis, M Lardelli, U Lendahl, l Thesleff : Expression of Notch 1,2 and 3 is regulated by epithelial-mesenchymal interactions and retinoic and in the developing mouse tooth and associated with determination of ameloblast cell fate. J Cell Biol 130:407-418,1995 | (*12 | TA Mitsiadis, T Muramatsu, H Muramatsu, l Thesleff : Midkine (MK),a heparin-binding growth/differentiation factor, is regulated by retinoic acid and epithelial-mesenchymal interactions in the developing mouse tooth, and affects cell proliferationand morphogenesis. J Cell Biol 129:267-281,1995 |