�Q�Y���̉i�}�Q�j
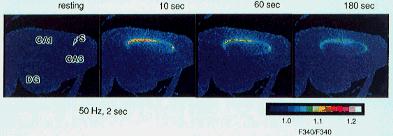
�@�r�ƋL�������ʂɎh���d�ɂĂĂQ�b�ԓd�C�h�����s���ƁA���̉����̂b�`�P�̈�V�i�v�X�w�ɃJ���V�E���Z�x�㏸���N����i���F�\�����㏸�������j�A����͂R���ȏ�c�����Ă���B
�A�r�ł݂���Z�x�㏸�̓V�i�v�X�����ł͂Ȃ��זE�̒��ړd�C�h���ɂ�����
�i������ȑ�E�H�����v�����j�B
�@�O�߂Ő��������悤�ɁA�_�o�זE�Ԃł̏��`�B�́A�������[�܂œ͂����d�C�M�������������A���w�����̕��o�E�g�U�E��e�E�d�C�M���̍Ĕ����Ƃ����菇��ōs����B�������[�܂œd�C�M�������Ă���̂�����A���̐_�o�זE�ɂ��̂܂ܓd�C�M����`����悤�ɂ�����悢�̂ɂƎv���邩������Ȃ����A�킴�킴�萔��������ɂ͏d�v�ȈӖ�������B
�@�菇�������قǁA���߂������邱�Ƃ��\�ɂȂ�A�Ⴆ�ΌW������Ă������E�̐�����������A�b���`���l���̐����������肵�ē`�B�����̕��o�ʂ������Γ`�B�����͍��܂邾�낤���A���o�ʂ͓����ł���e�̂̐�����������A�����d�ʂ̍Ĕ�����������悤�Ɍ`�Ԃ��ς��Ȃǂ���A��͂�`�B�����͍��܂�B�����Ď��ۂɔ]���ł����������Ƃ��N���Ă���B���������`�B�����̕ω����ۂ��w�V�i�v�X�Y���x�Ƃ����A�ω����N��������v�����w�Y���h���x�ƌĂԁB
�@�P�X�V�Q�N�v���X�ƃ����́A�E�T�M�̔]�ŊC�n�i�����t�̓����ɂ����]�玿�̈ꕔ�j�ւ̓��͐_�o�����p�x�Ŏh������Ƃ��̌�`�B���������{�����A���̌����A�b�v��Ԃ������Ԃ������Ƃ������ۂ����A�����������ہi�k�s�o�j�Ɩ��Â��Ĕ��\�����B���ꂪ�A����ȑO�ɂ͐S���w�̐��̈�Ƃ���Ă����L�����ۂ��זE�����w�̌����ΏۂɈ������낵���L�O���ׂ��ł���B
�@��������}���ɐi�����������w�I�Ȕ��ʕ��q��͋Z�p�̐i���ƕ��q�����w�I�ȉ�͕��@�Ƃ��A���̂k�s�o�̋@�\��͂ɓ������ꂽ���ʁA���݂܂łɂ��Ȃ�ڍׂɋ@�\���𖾂���Ă���B�܂��A�C�n�����łȂ��A�ق��̔]�̈�ł����l�Ȍ��ۂ�A���̑S�����̌��ہi����h�����s���Ɠ`�B�������������āA���̏�Ԃ��ێ�����錻�ۂŁA������}�����ۂƌĂсA��͂�V�i�v�X�Y���̈��Ƃ�����F�k�s�c�j���݂����Ă���B�k�s�o�ɂ͂������̌^�����邱���m���Ă��邪�A�ł��T�^�I�Ȍ^�ɂ��Đ������悤�B
�@�����_�o�n�œ`�B��S���Ă���`�B�����̎���̓O���^�~���_�ł���i�P�|�P�j�Q�Ɓj�B�J�����o���ꂽ�O���^�~���_���Ƃ炦�ē`�B������������O���^�~���_��e�̂ɂ́A�傫�������ĂQ��ނ�����B��͂`�l�o�`�^�i���̎�e�̂ɑI��I�ɓ����l�H�A�~�m�_�̓��������疽���������́j�A������͂m�l�c�`�^�i���̎�e�̂ɑI��I�ɓ����l�H�A�~�m�_�̓������j�Ƃ����B���݂ł͂��ꂼ��P�����ꕪ�q�\�����킩���Ă��閌�`�����ł���B
�@�������A�m�l�c�`�^�O���^�~���_��e�́i�Ȍ�m�l�c�`��e�̂Ɨ����j�́A�ӂ���̓V�i�v�X�Ԃɑ��ʂɑ��݂���l���Q�{�ɂ���čǂ���Ă���A�O���^�~���_����������Ƃ����Ċ����ł��Ȃ���Ԃɂ���B
�A�ӂ�������̂͂`�l�o�`�^�O���^�~���_��e�́i�Ȍ�`�l�o�`��e�̂Ɨ����j�ŁA�O���^�~���_����������Ɣ����J���Ăm���{��ʂ��B�Q�|�P�j�ŁA�E���ɂŔ����J���Ăm���{��ʂ��d�ʈˑ����m���`���l���̘b���������A�`�l�o�`��e�̂̓O���^�~���_�ˑ����m���`���l���Ƃ��������邱�Ƃ��ł���B�������čזE�O����Z�x���z�ɂ��������Ăm���{���������ċN����ω��͒E���ɂł���A�������������V�i�v�X�d�ʁi�d�o�r�o�j�Ƃ����B�d�o�r�o���\���ȑ傫���ɒB����A�d�ʈˑ����̂m���`���l�������������Ċ����d�ʂ��A�������������Ă����B
�@��ɂk�s�o�͍��p�x�h���ɂ���ĉ���Ɛ��������B���p�x�h���Ƃ́A�������[���������܂ɋ������J��Ԃ��A�O���^�~���_�����X�ƊJ�����o����A�d�o�r�o���A���I�ɔ������邱�Ƃł���B����Ƃm�l�c�`��e�̂��d�������グ��B�m�l�c�`��e�̂̂l���Q�{�ǂ͎����I�E���ɂɂ���ĉ�������B�`�l�o�`��e�̂̊����Ŕ��������E���ɂ��܂������āA�Ȃ��O���^�~���_���`�l�o�`��e�̂ɓ͂����Ƃ��A�m�l�c�`��e�̂͊��������Ăb���Q�{��ʂ�����J����B���������Ăm�l�c�`��e�͓̂d�ʁ^�O���^�~���_���҈ˑ����b���`���l���Ƃ����Ă��悢�B�������ăV�i�v�X��זE���ɂb���Q�{���ǂ��Ɨ������邱�ƂɂȂ�B
�@�k�s�o�͂��̂b���Q�{�Z�x�㏸�����������Ƃ��Ă͂��܂�B�T�|�Q�j�œo�ꂷ��b���Q�{�^�J�����W�������ˑ����`���L�i�[�[��b���Q�{�^���������ˑ����`���L�i�[�[�������o���A���낢��Ȓ`�����������_������B���̒��ɂ����炭�`�l�o�`��e�̂��܂܂�Ă���̂��낤�B
�A�����_�����ꂽ�`�l�o�`��e�̂͊������A�b�v���A���̌��ʁA���p�x�h�����I����Ăm�l�c�`��e�̊��������b���Q�{�Z�x�㏸���h���O�ɕ�������ł��A�`�l�o�`��e�̂��ȑO��萔�����O���^�~���_��҂����܂��Ă����Ԃ������B���ꂪ�k�s�o�ł���B�������A���ꂾ���ł̓����_����Ԃ��₪�Č��ɖ߂�ƂƂ��ɂk�s�o�������Ă��܂��̂ŁA�����炭���炩�̂ق��̋@�\�������āA�����_������������Ȃ�A�`�l�o�`��e�̒`���̍����ʂ𑝂��Ȃ�̋@�\�������̂��낤�B
�@���̂悤�ȋ@�\�ł��邩��A�k�s�o�̐����͂��낢��ȏ��u�őj�Q���邱�Ƃ��ł���A�זE�O�t����b���Q�{�������Ă��A�m�l�c�`��e�̂�j�Q�܂ŗ}���Ă��A�זE���ɓ������b���Q�{���z�����čזE���b���Q�{�Z�x���オ��Ȃ��悤�ɃL���[�g�܂𒍎˂��Ă��A���邢�͂b���Q�{�ˑ����`���L�i�[�[��j�Q���Ă��A�k�s�o�͋N����Ȃ��Ȃ�B�w�L���ɂ̓J���V�E�����d�v�x�Ƃ������������Ȃ���邪�A����͂��̂悤�ȈӖ��ł���B
�R�j�זE���i�̕ω�
�@�זE���ɂ͑���ނ̑@�ۏ�̍\���������āA�זE�̌`�E���͂̈ێ��╨���A����^���Ɋւ���Ă���B���̓T�^�I�ȗ�͇T�[�S�͂ʼn�������؍זE�̎��k�����A���l�̍זE���i�̐���@�\���A���ׂĂ̍זE�͔��B�̒��x�̍�������������Ă���B
�@�_�o�זE�͔��ɓ��قȌ`�����Ă���B�זE�̂������ɂP�{�́w�����x�Ƃ����ׂ��@�ۂ��A���̎w��̉^���_�o�Ȃ�A�Ґ����炻���܂łP���ȏ�ɂ킽���ĐL���A�����Ɂw����ˋN�x�Ƃ�����͂�ׂ��@�ۂ��A�`�B�����A���e�i�Ƃ��Ē����Ă���B���̂悤�ȑ@�ۏ�̍\���́A�����ɂ�����x����悤�ȍ\�����Ȃ�������܂�����Ă��܂��B�P����̖��[�܂ŕ⋋���₳�Ȃ����߂ɂ́A�����A���̑��u���Ȃ���Ȃ�Ȃ��B�܂��A�_�o�זE���V���Ȍ��������T���Ă����ۂɂ́A���R�^�����u�������Ă��Ȃ��Ă͂Ȃ�Ȃ��B
�@�\���ێ��ƗA���Ɋւ�鍜�i����������悤�B�����̓����ɂ͔����ǂƂ������a�Q�Tnm �̊ǂ����\�{�������Ă���B�����ǂ́A�`���[�u�����Ƃ����A���̓_���}�^�������`����������������i�d�������j�\���ł���B�����ǂ���̓}�b�v�ނƌĂ��`�����łł����w�}�x���זE���Ɍ����ē˂��o�Ă���A����������x������ɂȂ��Ă���B���������^��镨����\���̂ɂ́A�L�l�V���ƌĂԒ`�������t�����A���̕��q���G�l���M�[������Ȃ��瓖�\���̂�����ǂ̏�œ]�������낷�i���[����זE�̂̕��֏オ���Ă����ۂɂ́A�_�C�j���Ƃ����ʂ̒`�������\���̂�����ǂ̏�œ]�����^�ԁj�B�Ƃ����킯�ŁA�����ǂ͐_�o�זE�̌`�ԂƋ@�\���ێ����邤���ő�Ϗd�v�ȍ\���ł���B���̍\�����b���Q�{�ɂ���đ傫�ȉe������B
�@�������������ǂ͈���ŕs���̍\���ł͂Ȃ��A����������̒[�ō���i�E�d�����j�����̒[�ŐL�сi�d�����j�Ă���A���̃o�����X�Ō���������̒����ɕۂ���Ă���B�����ǂ̒Z�k�ƐL���̃o�����X�͂b���Q�{�Z�x����P�O-5�l��荂���Ȃ�ƒZ�k���ɌX���A���鎞�Ԉȏセ�ꂪ�����Ɣ����ǂ͕���B���ɂ���_�o�זE�łb���Q�{�Z�x�����܂�ƁA�����͐���̂悤�Ƀu�c�u�c�Ɛ��f����Ă��܂��B���̂悤�ɂb���Q�{�͎����ɂƂ��ċ����ŕ��ł���B
�@�O�߂܂ŁA�b���Q�{�Z�x�����܂��ē`�B���������o�����Ƃ��A�b���Q�{�Z�x�����܂��ċL������������Ƃ��A�b���Q�{�́w�V�ʁx�̖ʂ��������Ă����̂ɁA�����ŋ}�Ɂw���ʁx�̘b�ɂȂē��f���ꂽ��������Ȃ��B�������A�זE���̂b���Q�{�͊�{�I�ɂ͓ŕ��ł���B�����炱���A�ӂ����ʂ̃G�l���M�[���₵�čזE���̂b���Q�{��Ⴍ�ۂ��Ă���B�זE�͂��̓ŕ����ق�̒Z���ԍזE���ɓ��邱�Ƃ������ĐM���Ɏg���Ƃ����A���Ɋ�Ȃ����Ƃ����Ă���B���������āA�זE���b���Q�{�㏸��������Ԃ͎��q�ゲ������ꂽ�͈͓��ŁA�`�B�����̕��o�̍ۂɂb���Q�{�Z�x���P�O-5�l�ȏ�ɏオ��̂��A�m�l�c�`��e�̂̊������ŃV�i�v�X��זE�̂b���Q�{�Z�x���オ��̂��A�b���`���l����m�l�c�`��e�̂̋ߖT�P�ʂ��ȉ��Ɍ����Ă���B
�@���ɉ^���̋@�\�ɂ��Ęb��i�߂悤�B�L��������_�o�ˋN�i�����Ǝ���ˋN�j�̐�[�́A�����~���ƌĂ��A���[�o��̐G��l�\���ɂȂ��Ă��āA�w�̂悤�ȍׂ��ˋN��������ɏo�����ꂵ�Ȃ���A����̕����i�Ⴆ�ΗU�������̔Z�x�̍��������j�֔����i��ł����B���̂Ƃ��A�����~�����̍זE���i�́A�d���ƒE�d���Ƃ��J��Ԃ��č����ɍĕҐ����Ă��Ȃ���Ȃ�Ȃ����A����ɂ̓Q���]������A�N�`�m�Q�����Ƃ����`�������[���ւ���Ă���B�����̒`�����̊����͂P�O-6�l���x�̂b���Q�{�Z�x�ŕω�����B���������āA�זE���̂b���Q�{�Z�x�߂���@�\���A�ԐړI�ɓˋN�̐L�������䂵�Ă��邱�ƂɂȂ�B
�S�j�_�o�זE�̐���
�@�������̂��炾�̖Ɖu�n���N�������ۂ��E���ۂɂ́A�R�̂��܂��ۂɂƂ���A����ɕ�̂Ƃ����`�����Q���������A��̂�����J���V�E�����H���ۂ̍זE���ɂb���Q�{���ʗ��������čۂ�j��B�זE�����̂b���Q�{�Z�x�̍�����Ԃ���������Ɣj���͍̂ۂ���ł͂Ȃ����������g�̍זE�����l�ł���B
�A�זE���ɂ͂b���Q�{�ɂ���Ċ����������y�f������ނ��邪�A���̒��ɒ`���������y�f�⎉�������y�f������B����炪�w����āx�����������A�זE���g�̍\����זE�������A�������Ă��܂��B�O�߂łb���Q�{�͖{���I�ɓłł���Əq�ׂ��̂͂��̈Ӗ��ł���B
�@�]�̌��ǂ��l�܂�����i�]�����j�j�ꂽ��i�]�쌌�j���āA���������Ɍ��������Ȃ��Ȃ�ƁA�ӂ����ʂ̃G�l���M�[���g���ċ��ݏo���Ă����b���Q�{�����ݏo���Ȃ��Ȃ��Đ_�o�זE���̂b���Q�{�Z�x���㏸���͂��߂�B����ƁA�R�|�P�j�Ő��������悤�ɃO���^�~���_�̊J�����o���͂��܂�B����ƂR�|�Q�j�Ő��������悤�ɂm�l�c�`��e�̂�����������čזE���ɂb���Q�{����������B�����ł������ݏo������Ȃ������b���Q�{�̂����ɁA�V���ȗ����������킯�ł���B
�A����ɁA�_�o�זE���ɂ͂��̂b���Q�{�𗘗p���ē`�B���������߂Ă����@�\��������Ă���킯������A���ꂪ�w�ɂȂ��Ă܂��܂��O���^�~���_�̕��o���m�l�c�`��e�̂̊��������b���Q�{�̗����Ƃ����T�C�N��������Ă��܂��B�]�זE���_�f���R�Ɏア�̂ɂ͂��̂悤�Ȕw�i������B
�@�]�쌌����ߎ��̂̂悤�ɐ_�o�זE�̑�ʎ����N����悤�Ȏ��ԂłȂ��Ă��A������Ƃ����Ǐ��I�Ȍ�����o���ŏ����̐_�o�זE���j���悤�Ȏ��Ԃ́A���͓��퐶���̒��ŕp�ɂɋN���Ă���̂��낤�B
�@���{�l�̘V�N�s���̉ߔ������߂�]���ǐ��s���i�c��̓A���c�n�C�}�[�^�s���j�́A���̂悤�Ȕ]���Ǐ�Q�ɂ��_�o�E�����~�ς��Ĕ��ǂ���Ǝv����B�������A�����h�����Ƃ��Đ_�o�זE�̎��͂���b���Q�{�������Ɓi���̂̍P�퐫�ێ��@�\���������炻���������Ƃ͎��ۂ͂ł��Ȃ����A����ɂł����Ƃ��Ă��j�A�V�i�v�X�Y�����~�߂Ă��܂����ƂɂȂ邩��Ӗ����Ȃ��B���ǂ����Ȃ��悤��������h������A���ǂ��l�܂�Ȃ��悤�R���X�e���[���̒~�ς�h�����Ƃ��l����ׂ��ł���B