寣娗偲僇儖僔僂儉 妢堜桋戙丗搶嫗戝妛堛妛晹戞堦栻棟
|
|
侾丏寣娗偺婎杮峔憿
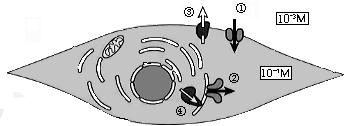
丂寣娗偺婎杮揑側峔憿偼丄撪旂嵶朎偐傜側傞撪枌丄暯妸嬝偑庡偲側傞拞枌丄偦偟偰寢崌慻怐偑朙晉側奜枌偺俁憌偐傜側傞丅
丄寣娗撪旂嵶朎偼丄寣娗撪峯懁丄偮傑傝寣塼偑棳傟傞懁偵柺偟偰懚嵼偟丄寣塼偲慻怐娫偺暔幙丒僈僗岎姺偺応偲側偭偰偄傞丅偝傜偵撪旂嵶朎偺廳梫側婡擻偲偟偰丄峈寣愷嶌梡傪傕偮傎偐丄寣娗嶌摦惈暔幙傕暘斿偟偰偄傞丅
丄寣娗暯妸嬝嵶朎偼丄寣娗傪庢傝埻傓傛偆偵攝楍偟丄摦柆宯偱偼摿偵枾偵懚嵼偟偰拞枌傪宍惉偡傞丅寣娗暯妸嬝嵶朎偼丄儂儖儌儞偁傞偄偼寣娗塣摦恄宱偺巟攝傪庴偗丄忢偵偁傞掱搙偺嬞挘傪曐偭偰偄傞丅
丄奜枌偺寢崌慻怐拞偵偼丄岎姶恄宱愡屻慄堐偑僱僢僩儚乕僋傪偮偔偭偰懚嵼偟偰偄傞丅岎姶恄宱慄堐偺朿戝晹偵挋憼偝傟偰偄傞恄宱揱払暔幙偺僲儖傾僪儗僫儕儞偼丄妶摦揹埵乮僀儞僷儖僗乯偵敽偭偰曻弌偝傟丄岠壥婍偱偁傞寣娗暯妸嬝嵶朎偺廂弅傪堷偒婲偙偟偰偄傞丅仭丒崁栚偵栠傞俀丏帺棩恄宱偵傛傞寣娗偺廂弅惂屼
丂枛徑偺摦柆乮掞峈寣娗乯偺寣娗嬞挘偑憹壛偡傞偲丄寣娗撪宎偺尭彮偑婲偙傝寣棳掞峈偑忋徃偡傞丅寣埑偼丄怱攺弌検偲枛徑寣棳掞峈偺愊偵偍偍傓偹斾椺偡傞偨傔丄掞峈寣娗偺廂弅惂屼婡峔偼丄寣埑偺堐帩丒挷愡偵偍偄偰廳梫側栶妱傪傕偭偰偄傞丅
丄岎姶恄宱愡屻慄堐偼傾僪儗僫儕儞嶌摦惈慄堐偱偁傝丄寣娗暯妸嬝嵶朎偺兛庴梕懱傪夘偟偰丄嵶朎撪僇儖僔僂儉挋憼晹埵偐傜偺僇儖僔僂儉曻弌傗丄嵶朎奜偐傜偺僇儖僔僂儉棳擖傪堷偒婲偙偟偰丄暯妸嬝嵶朎撪僇儖僔僂儉擹搙傪忋徃偝偣偰丄寣娗傪廂弅偝偣傞丅
丄幚嵺偵偼丄寣娗暯妸嬝偺嬞挘忬懺傪曐偮偨傔偵丄岎姶恄宱愡屻慄堐偼愨偊偢僀儞僷儖僗傪敪惗偟偰偄傞丅僀儞僷儖僗昿搙偑憹壛偡傞偲丄僲儖傾僪儗僫儕儞偺曻弌偑憹壛偟偰偝傜偵寣娗嬞挘傪崅傔丄媡偵僀儞僷儖僗昿搙偑掅壓偡傞偲丄僲儖傾僪儗僫儕儞偺曻弌偼尭彮偟偰寣娗偼抩娚傊孹偔丅偙偺傛偆偵丄岎姶恄宱偼寣娗暯妸嬝偺嵶朎撪僇儖僔僂儉擹搙惂屼傪廳梫側梫場偲偟偰丄寣娗塣摦傪挷愡偟偰偄傞丅仭丒崁栚偵栠傞俁丏寣娗暯妸嬝嵶朎撪僇儖僔僂儉擹搙惂屼婡峔
丂暯妸嬝嵶朎偵偍偗傞嵶朎撪僇儖僔僂儉摦堳婡峔偺棯恾傪恾侾偵帵偡(*1)丅
嘆俠倎俀亄僠儍僱儖
丄枌揹埵埶懚惈
丄庴梕懱嫟栶宆
丄俠倎俀亄僗僩傾嫟栶宆
丄婡夿庴梕
嘇俠倎俀亄曻弌僠儍僱儖
丄儕傾僲僕儞庴梕懱
丄嘥俹俁庴梕懱
俠倎俀亄攔弌婡峔
嘊俠倎俀亄億儞僾乮嵶朎枌宆乯偁傞偄偼
丄俶倎亄乛俠倎俀亄岎姺婡峔
嘋俠倎俀亄億儞僾乮彫朎懱乯亂恾侾亃寣娗暯妸嬝嵶偺俠倎俀亄擹搙惂屼婡峔
丂嵶朎撪奜偵偼丄侾枩攞偺僇儖僔僂儉擹搙嵎偑偁傞偺偱丄嵶朎撪偵僇儖僔僂儉傪摦堳偡傞婡峔偺堦偮偲偟偰嵶朎奜偐傜偺棳擖偵傛傞宱楬偑偁傞丅傑偨丄嵶朎撪偱偼丄庡偲偟偰彫朎懱偑僇儖僔僂儉挋憼屔乮僗僩傾乯偲偟偰婡擻偟偰偍傝丄偙偙偐傜傕僇儖僔僂儉偼曻弌偝傟傞丅
丄嵶朎奜偐傜偺僇儖僔僂儉棳擖宱楬偵偼丄侾乯枌揹埵埶懚惈俠倎僠儍僱儖丄俀乯庴梕懱嫟栶宆俠倎僠儍僱儖丄俁乯僇儖僔僂儉僗僩傾嫟栶宆俠倎僠儍僱儖丄係乯婡夿庴梕僠儍僱儖側偳偑偁傞丅
丄堦曽丄嵶朎撪僇儖僔僂儉僗僩傾偐傜偺僇儖僔僂儉曻弌宱楬偲偟偰偼丄侾乯僀僲僔僩乕儖嶰儕儞巁乮嘥俹俁乯庴梕懱偲丄俀乯儕傾僲僕儞庴梕懱偑偁偘傜傟傞(*2)丅丂枌揹埵埶懚惈俠倎僠儍僱儖偵偼丄俿宆傗俴宆側偳偑偁傝丄椉幰偵偼枌揹埵埶懚惈傗暯嬒奐岥帪娫側偳偵堘偄偑偁傞丅暯妸嬝嵶朎偵懡偔敪尰偟偰偄傞俴宆俠倎僠儍僱儖偼丄僕僸僪儘僺儕僕儞宯僇儖僔僂儉漢峈栻偱幷抐偝傟傞丅庬乆偺傾僑僯僗僩乮儂儖儌儞丄恄宱揱払暔幙側偳乯偼丄嵶朎枌忋偺僀僆儞慖戰惈偺掅偄僠儍僱儖傪奐偒丄扙暘嬌傪婲偙偡寢壥丄擇師揑偵枌揹埵埶懚惈俠倎僠儍僱儖傪奐岥偝偣偰丄僇儖僔僂儉棳擖傪婲偙偡偙偲偑偁傞丅
丂庴梕懱嫟栶宆俠倎僠儍僱儖偼丄傾僑僯僗僩偑庴梕懱偵寢崌偟偰捈愙俠倎僠儍僱儖傪奐岥偝偣傞傕偺偲掕媊偝傟傞偑丄暘巕儗儀儖偱偼傑偩晄柧偺揰偑懡偄丅僂僒僊帹摦柆暯妸嬝側偳偵偍偄偰丄俙俿俹庴梕懱偱偁傞偲偲傕偵僀僆儞僠儍僱儖偱傕偁傞俹俀倃庴梕懱偺懚嵼偑曬崘偝傟偰偄傞(*俁)丅偙傟偼丄斾妑揑僇儖僔僂儉偵懳偡傞慖戰惈偑崅偄丅偟偐偟偙傟埲奜偵偼丄尩枾偵枌揹埵埶懚惈僠儍僱儖偲嬫暿偝傟偨僠儍僱儖偼尰嵼傑偱偺偲偙傠曬崘偝傟偰偄側偄丅
丂偦偺懠偵丄僇儖僔僂儉僗僩傾偑屚妷偡傞偲奐岥偡傞僇儖僔僂儉僗僩傾嫟栶宆俠倎僠儍僱儖丄嵶朎枌偺怢揥側偳偺婡夿揑巋寖偵傛偭偰奐偔婡夿庴梕僠儍僱儖側偳偑曬崘偝傟偰偄傞偑丄幚懱偵偮偄偰偼傑偩廫暘偵柧傜偐偵側偭偰偄側偄丅
仭丒崁栚偵栠傞係丏寣娗暯妸嬝嵶朎偺僇儖僔僂儉僆僔儗乕僔儑儞
丂偡偱偵弎傋偨傛偆偵丄寣娗暯妸嬝嵶朎偺嵶朎撪僇儖僔僂儉擹搙惂屼偼丄寣娗嬞挘偺曐帩丒挷愡偺婎慴傪側偟丄寣埑惂屼偵怺偔娭梌偟偰偄傞丅寣娗暯妸嬝偺僇儖僔僂儉摦堳惂屼婡峔傪柧傜偐偵偡傞偙偲偼丄崅寣埑側偳偺昦懺惗棟丄帯椕栻偺栻棟嶌梡傪棟夝偡傞偆偊偱廳梫偱偁傞丅
丂偙傟傑偱偺嵶朎撪僇儖僔僂儉摦堳偵娭偡傞尋媶偱偼丄寀岝暘岝岝搙寁傪梡偄偰丄寣娗慻怐慡懱偺暯妸嬝嵶朎偺僇儖僔僂儉斀墳偺暯嬒壔偟偨傕偺傪應掕偡傞偐丄尠旝寀岝應岝偵傛傝丄扨棧嵶朎偁傞偄偼攟梴宯偱屄乆偺嵶朎偺僇儖僔僂儉曄壔傪應掕偡傞曽朄偑峀偔巊梡偝傟偰偄偨丅偙偺傛偆側尋媶偺埫栙偺慜採偲偟偰丄偡傋偰偺暯妸嬝嵶朎偑堦條偵斀墳偡傞偲峫偊傜傟偰偒偨(*係丄*俆)丅偟偐偟丄幚嵺偺慻怐撪偱屄乆偺嵶朎偑宱帪揑偵偳偺傛偆偵斀墳偟偰偄傞偐偵偮偄偰偼柧傜偐偱側偐偭偨丅
丂嵟嬤偵側偭偰丄寣娗暯妸嬝偺嵶朎撪僇儖僔僂儉擹搙偺曄壔傪丄嫟徟揰儗乕僓乕尠旝嬀傪梡偄偰丄崅偄嬻娫暘棧擻偲廫暘側帪娫暘夝擻傪傕偭偨擇師尦夋憸偵傛傝娤嶡偡傞偙偲乮僇儖僔僂儉僀儊乕僕儞僌乯偑壜擻偲側偭偨丅嫟徟揰儗乕僓乕尠旝嬀偼丄徟揰怺搙偺愺偄寀岝尠旝嬀偱偁傝丄慻怐昗杮傪梡偄偰傕丄岤偝悢儈僋儘儞偺抐憌憸傪娤嶡偡傞偙偲偑偱偒傞丅偦偺寢壥丄攟梴傗媫惈扨棧偲偄偭偨張抲傪峴傢側偔偰傕丄慻怐峔抸傪巆偟偨寣娗暻偺忬懺偺傑傑偱丄暯妸嬝嵶朎憌偵徟揰柺傪崌傢偣偰丄屄乆偺嵶朎偺僇儖僔僂儉僔僌僫儖傪娤嶡偡傞偙偲偑偼偠傔偰壜擻偲側偭偨(*俇)丅
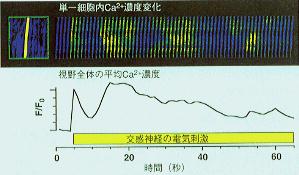
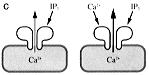
丂儔僢僩旜摦柆寣娗慻怐偵寀岝僇儖僔僂儉巜帵栻僼儖僆乮Fluo亅俁乯傪晧壸偟偨屻丄岎姶恄宱僱僢僩儚乕僋傪揹婥巋寖偡傞偲丄偡傋偰偺暯妸嬝嵶朎偑摨婜偟偰斀墳偡傞偺偱偼側偔丄廬棃偺埫栙偺壖掕偵斀偟偰丄屄乆偺暯妸嬝嵶朎偱偽傜偽傜偵丄嵶朎撪僇儖僔僂儉擹搙偺廃婜揑側忋徃偑娤嶡偝傟偄傞丅
丂偙偺廃婜揑僇儖僔僂儉擹搙忋徃乮僇儖僔僂儉僆僔儗乕僔儑儞乯偼丄嬻娫揑偵傒傞偲嵶朎撪傪俀侽兪倣乛倱掱搙偺僗僺乕僪偱揱攄偡傞僇儖僔僂儉僂僃乕僽傪宍惉偟偰偍傝乮恾俀乯丄嵶朎撪僇儖僔僂儉曻弌偵埶懚偟偨斀墳偱偁傞偙偲偑柧傜偐偵偝傟偨(*俇)丅
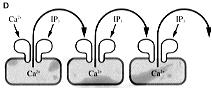
亂恾俀亃寣娗暯妸嬝嵶朎偺嵶朎撪俠倎俀亄 丂偙偺僇儖僔僂儉僆僔儗乕僔儑儞乛僇儖僔僂儉僂僃乕僽偼丄恄宱傪揹婥巋寖偟偨応崌偩偗偵傒傜傟傞傕偺偱偼側偔丄堦掕偺擹搙偺僲儖傾僪儗僫儕儞偱暯妸嬝傪巋寖偟偰傕娤嶡偝傟偨丅傑偨丄寣娗廂弅暔幙偱偁傞傾儞僕僆僥儞僔儞偱傕丄摨條偺寢壥偑摼傜傟偰偄傞丅偙偺偙偲偐傜丄偙偺僇儖僔僂儉僆僔儗乕僔儑儞乛僇儖僔僂儉僂僃乕僽偼丄恄宱揱払暔幙偺擹搙偑曄摦偟偰偄偨偨傔偵堷偒婲偙偝傟偨斀墳偱偼側偔丄摦柆暯妸嬝嵶朎偺婎杮揑側僇儖僔僂儉擹搙忋徃僷僞乕儞偲峫偊傜傟傞丅傑偨丄僇儖僔僂儉僆僔儗乕僔儑儞偼嵶朎偛偲偵堎側偭偨帪憡偱婲偙傞偨傔丄暯嬒壔偝傟偨慻怐慡懱偺斀墳偱偼僇儖僔僂儉擹搙曄壔偼僆僔儗乕僔儑儞偲偟偰偼娤應偝傟偢丄暯妸側斀墳偲偟偰偺傒娤應偝傟傞丅偡側傢偪丄夋憸夝愅朄偵傛傝丄偡傋偰偺暯妸嬝嵶朎偼摨偠傛偆偵斀墳偡傞偲偄偆廬棃偺奣擮傪峏怴偡傞寢壥偑摼傜傟偰偄傞丅
仭丒崁栚偵栠傞俆丏僇儖僔僂儉僂僃乕僽偺儊僇僯僘儉
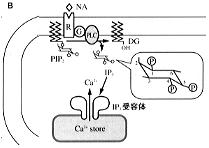
丂暯妸嬝嵶朎偵偼丄僲儖傾僪儗僫儕儞偵懳偡傞兛庴梕懱偑懚嵼偟丄偙偺庴梕懱偑巋寖偝傟傞偲乮恾俁俙乯丄儂僗儂儕僷僛俠偑妶惈壔偝傟偰丄嵶朎枌捈壓偱嘥俹俁偑嶻惗偝傟傞丅
丂偙偺嘥俹俁偼丄嵶朎撪偵奼嶶偟嘥俹俁庴梕懱偵寢崌偟偰丄嵶朎撪僇儖僔僂儉僗僩傾偐傜偺僇儖僔僂儉曻弌傪懀偡乮恾俁俛乯丅
丂幚偼丄偙偺嘥俹俁偵傛傞僇儖僔僂儉曻弌偵偼僇儖僔僂儉姶庴惈偑偁傝丄惗棟揑擹搙忦審偱偼丄僇儖僔僂儉偼嘥俹俁偵傛傞僇儖僔僂儉曻弌傪懀恑偡傞乮恾俁俠乯(*俈丄俉)丅
丂偙偺傛偆側嘥俹俁庴梕懱偺惈幙偵傛傝丄僇儖僔僂儉僂僃乕僽偺敪惗婡峔偼師偺傛偆偵棟夝偝傟傞丅
丂偡側傢偪丄嵶朎撪偱嘥俹俁擹搙偑忋徃偟偰傕丄偦傟偩偗偱偼晄廫暘偱丄僇儖僔僂儉曻弌偼婲偒側偄丅
丂偟偐偟丄偳偙偐侾僇強偱僇儖僔僂儉曻弌偑婲偙傞偲丄偦傟偑丄嬤朤偺嘥俹俁庴梕懱傪傪妶惈壔偡傞丅偦傟偑傑偨偝傜偵椬偺嘥俹俁庴梕懱傪妶惈壔偡傞丅偪傚偆偳僪儈僲搢偟偺傛偆偵丄侾僇強偰並僇儖僔僂儉曻弌偑婲偒傞偲丄偦傟偑丄師乆偲懕偄偰偄偔偙偲偵傛傝僇儖僔僂儉僂僃乕僽偑婲偒傞偲峫偊傜傟偰偄傞乮恾俁俢乯丅
 仭丒崁栚偵栠傞
仭丒崁栚偵栠傞俇丏寣娗偺抩娚偲撪旂嵶朎
丂寣娗暯妸嬝偺廂弅丒抩娚偼丄寣娗撪旂嵶朎偐傜曻弌偝傟傞壔妛暔幙偵傛傝惂屼傪庴偗偰偄傞丅寣娗撪旂嵶朎偼丄傾僙僠儖僐儕儞丄僾儔僕僉僯儞丄僒僽僗僞儞僗俹丄僩儘儞僺儞丄偢傝墳椡側偳偺巋寖偵傛傝丄撪旂桼棃寣娗抩娚場巕傪曻弌偡傞(*俋)丅
丄偙偺撪旂桼棃寣娗抩娚場巕偺戙昞揑側傕偺偼丄堦巁壔拏慺乮俶俷乯偱偁傞(*侾侽丆侾侾)丅撪旂嵶朎偵偼僇儖僔僂儉乛僇儖儌僕儏儕儞埶懚惈偺峺慺偱偁傞俶俷崌惉峺慺偑懚嵼偟丄撪旂嵶朎撪偺僇儖僔僂儉擹搙忋徃偑丄俶俷崌惉偺堷偒嬥偲側傞丅丂傾僙僠儖僐儕儞傗僾儔僕僉僯儞偱撪旂嵶朎傪巋寖偡傞偲丄撪旂嵶朎偵偍偄偰傕丄僇儖僔僂儉僆僔儗乕僔儑儞傗僇儖僔僂儉僂僃乕僽偑娤嶡偝傟傞丅偙傟偵嵺偟偰俶俷偑嶻惗偝傟丄寣娗暯妸嬝嵶朎偵奼嶶偟偰僌傾僯儖巁僔僋儔乕僛傪妶惈壔偡傞偲丄嵶朎撪僇儖僔僂儉擹搙偑掅壓偟丄廂弅抈敀宯偺僇儖僔僂儉姶庴惈傕掅壓偡傞丅椉曽偺嶌梡偑憡忔揑偵嶌梡偟偰寣娗偺抩娚傪堷偒婲偙偡偲峫偊傜傟偰偄傞偑丄偦傟偧傟偺儊僇僯僘儉偼柧傜偐偱側偄丅
丂傾僙僠儖僐儕儞偱撪旂嵶朎傪巋寖偟偨忬懺偱丄摨帪偵岎姶恄宱傪揹婥巋寖偟偰丄暯妸嬝嵶朎偵偍偗傞僇儖僔僂儉擹搙曄壔傪僇儖僔僂儉僀儊乕僕儞僌朄傪梡偄偰娤嶡偟偰傒傞偲丄屄乆偺嵶朎偵偍偗傞僇儖僔僂儉僆僔儗乕僔儑儞偺昿搙偑尭彮偟偰偄傞偙偲偑傢偐偭偰偒偨丅
丄偙偺傾僙僠儖僐儕儞偺暯妸嬝偺僇儖僔僂儉墳摎偵懳偡傞岠壥偼丄俶俷崌惉慾奞栻偱偁傞俴亅俶俙俵俤搳梌偵傛傝徚幐偟偨丅偙偺偙偲偐傜丄偙傟傜偺傾僙僠儖僐儕儞偵傛傞斀墳偼丄庡偲偟偰俶俷傪夘偡傞傕偺偲峫偊傜傟丄僇儖僔僂儉僆僔儗乕僔儑儞婡峔偵嶌梡偟偰嵶朎撪僇儖僔僂儉擹搙掅壓嶌梡傪媦傏偟偰偄傞偙偲偑柧傜偐偵側偭偰偒偨丅丂崀埑栻偲偟偰峀偔梡偄傜傟偰偄傞僇儖僔僂儉漢峈栻偺嶌梡晹埵偼丄枌揹埵埶懚惈俴宆俠倎僠儍僱儖偱偁傞偙偲偐傜丄寣娗抩娚嶌梡偺儊僇僯僘儉偼丄寣娗暯妸嬝嵶朎撪傊偺僇儖僔僂儉棳擖傪梷惂偟偰嵶朎撪僇儖僔僂儉擹搙傪帩懕揑偵掅壓偝偣傞偙偲偲峫偊傜傟偰偒偨丅
丄幚嵺丄慻怐慡懱偱暯嬒壔偟偨暯妸嬝嵶朎撪僇儖僔僂儉擹搙應掕偱偼丄僇儖僔僂儉漢峈栻懚嵼壓偵帩懕揑僇儖僔僂儉擹搙掅壓偑娤應偝傟偰偄傞丅
丄偟偐偟丄摦柆暻偺僇儖僔僂儉僀儊乕僕儞僌偵傛傞嵟嬤偺寢壥偱偼丄僇儖僔僂儉漢峈栻偺堦偮偱偁傞僯僇儖僕僺儞偼丄屄乆偺嵶朎儗儀儖偱僇儖僔僂儉僆僔儗乕僔儑儞偺昿搙傪掅壓偝偣偰偄傞偙偲偑帵偝傟偰偄傞丅丂偙偺寢壥偼丄僇儖僔僂儉棳擖梷惂偑捈愙偺僇儖僔僂儉擹搙掅壓偺婡彉偱偼側偔丄偙傟偵傛傝僇儖僔僂儉僆僔儗乕僔儑儞傪婲偙偟偵偔偔偡傞偙偲偑丄僇儖僔僂儉漢峈栻偺嶌梡偱偁傞偙偲傪帵嵈偟偰偄傞丅
仭丒崁栚偵栠傞偍傢傝偵
丂嵟怴偺僇儖僔僂儉僀儊乕僕儞僌朄傪嬱巊偟偰丄慻怐峔抸傪堐帩偟偨寣娗暻偵偍偗傞屄乆偺嵶朎墳摎傪壜帇壔偡傞偙偲偵傛傝丄寣娗暯妸嬝嵶朎偱偼丄僇儖僔僂儉僆僔儗乕僔儑儞乛僇儖僔僂儉僂僃乕僽偑廂弅偺惂屼偵怺偔娭梌偟偰偄傞偙偲傪奣愢偟偨丅
丄偝傜偵僇儖僔僂儉漢峈栻傗俶俷側偳偺寣娗抩娚栻偼丄僇儖僔僂儉僆僔儗乕僔儑儞偺昿搙傪曄偊傞偙偲偵傛傝丄寣娗偺抩娚傪堷偒婲偙偟偰偄傞偙偲偑帵嵈偝傟偰偄傞丅嵶朎撪僗僩傾偐傜偺僇儖僔僂儉曻弌偵傛傝丄僇儖僔僂儉僆僔儗乕僔儑儞乛僇儖僔僂儉僂僃乕僽偑宍惉偝傟偰偍傝丄偙偺挷愡婡峔偼丄嵶朎奜偐傜偺僇儖僔僂儉棳擖婡峔偲偲傕偵丄寣娗嬞挘偺堐帩丒惂屼偵廳梫偩偲峫偊傜傟傞丅仭丒崁栚偵栠傞嶲峫暥專
(*1) Boltom TB : Mechanism of action of transmitters and other substances on smooth muscle. Physiol Rev 59:606-718,1979 (*2) Iino M : Calcium release mechanisms in smooth muscle. Jpn J Pharmacol 54:345-354,1990 (*3) Benham CD, Tisen RW : A novel receptor-operated俠倎俀亄permeable channel activated by ATP in smooth muscle.Nature328:275-278,1987 (*4) Xiao X-H, Rand MJ : 兛2-Adrenoceptor agonists enhance vasoconstrictor responses to 兛-adrenoceptor agonists in the rat tail artery by increasing the influx of 俠倎俀亄. Br J Pharmacol 98:1032-1038,1989 (*5) Nelson MT, Quayle JM : Physiological roles and properties of potassium channels in arterial smooth muscle. Am J Physiol 268;C799-C822,1995 (*6) lino M, Kasai H et al. Visualization of neural control of intracellular俠倎俀亄 concentration in single vascular smooth muscle cells. in situ EMBOJ13:5026-5031,1994 (*7) lino M : Biphasic俠倎俀亄dependence of inositol 1,4,5-trisphosphate^induced 俠倎俀亄 release in smooth muscle cells of the guinea-pig taenia caecl. J Gen Physiol 95:1103-1122,1990 (*8) lino M, Endo M : Calcium-dependent immediate feedback control of inositol 1,3,5-trisphosphate-induced 俠倎俀亄release. Nature 360:76-78,1992 (*9) Moncada S, Palme RM et al. nitric oxide : Physiology, pathophysiology, and pharmacology. PharmacolRev 43:109-142,1991 (*10) Knowles RG, moncada S : Nitric oxide as a signal in blood vesseis. Trends Biochemi Sci 17:399-402,1992 (*11) Person PB : Modulation of cardiovascular control mechanisms and rheir interaction . Physiol Rev 76(1):193-244,1996