はじめに
5億年以上前のカンブリア紀の海底に生存していた5cmほどの扁平な生物ピカイアの化石には体節(からだの節目)があったため、発見当初ピカイアはヒルやゴカイの仲間(環形動物)と考えられていた。しかし、その後の研究によりピカイアはからだの背面に1本の筋(脊索)があり、その両側には筋肉の筋(筋節)をもっていたことが明らかになったため、最も古い脊椎動物の原型と考えられるようになった(*1)。
、また、現在でも海底に棲息するナメクジウオ(脊索動物)も骨格はもたないが、脊索をもつためにピカイアに類似した生物として注目されている。これらの生物を原型として、背骨を有する脊椎動物である魚類が進化し、さらに魚類が陸に上がり、四足動物、二足動物が進化してきたと考えられている。このような進化の過程における骨格の変化を考えると、骨格が進化の過程でいかに重要な役割を担っていたかが容易に理解できる。
一方、最近、細胞生物学的・遺伝子工学的な手法が骨組織の研究にも導入され、骨格の形成機構も分子レベルで解析できるようになってきた。さらに、骨格を構成する細胞群の分化の調節機構も詳細に解析されつつある。種々の代謝性骨疾患の病態やその治療法を検討するには、骨格の進化の過程や骨格形成のメカニズムを理解しておくことが重要と考えられる。そこで、本章ではまず骨格の形成について最近の知見を含めて概説し、次いで骨格系を構成する細胞群の分化の調節機構についてわれわれの研究結果を中心にして概説したい。
1)外骨格と内骨格
脊椎動物の骨格を構成するのは骨組織と軟骨組織で、特に骨は多くの脊椎動物の主要な骨格形成要素である。 哺乳類では頭蓋骨の大部分と鎖骨が、膜性骨化によって形成され、外骨格の名残と考えられる。一方、内骨格はからだの深部に存在する骨格で、まず軟骨として形成され、下等動物では終生軟骨のまま骨格を保持するものがあるが、多くの脊椎動物ではからだの内部で形成された軟骨部に骨が添加して(軟骨内骨化)内骨格が形成される。 このように骨格は、頭蓋骨や鎖骨のように膜性骨化でできる外骨格と椎骨や長管骨のように軟骨内骨化でできる内骨格に大別するのが一般的である。 | 【図1)】皮甲から皮骨への進化 無顎類の皮甲はその後の進化の過程でさらに強固な『皮骨』となり、哺乳類まで引き継がれた。ヒトの頭蓋骨と鎖骨は、この皮骨に由来するものである(図は三木成夫、1985より/グレーの部分が皮骨であることを示す) 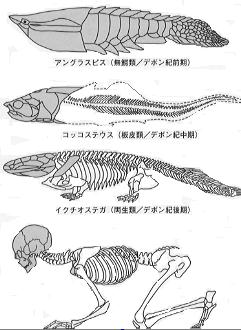 |
一方、無軟骨形成症という疾患では、内骨格に属する椎骨や大腿骨の軟骨部の著明な形成不全がみられるが、外骨格である頭蓋骨や鎖骨には異常がない。このような疾患が存在することは、外骨格と内骨格を形成する細胞の由来が異なり、両者間の骨組織に何らかの違いが存在する可能性を示唆している。なお、鎖骨頭蓋異骨症では骨芽細胞の分化と骨形成に必須のCbfa1の異変が(*2)、無軟骨形成症ではFibroblast Growth Factor ( FGF )受容体( FGFR-3 )の異変(*3)が、その成因の一つとして明らかにされている。
著明な古生物学者 Romer は内骨格と体性骨格と内臓性骨格に区別している(*1)。そして、体性骨格を、さらに椎骨などの体軸を構成する中軸骨格と、四肢(体指)を構成する体肢骨格とに分類している。
、また、 Romer のいう内臓性骨格とは鰓弓骨格のことで、鰓装置の支持と運動にあづかる骨格のことである。魚類や両生類の幼生では鰓が重要な機能を持っているために鰓弓骨がよく発達している。ヒトや四足動物では、舌骨、甲状軟骨、顎骨、耳骨の一部が鰓弓に由来する鰓弓骨格である。
、そして、 Romer は内臓性骨格以外の骨格は中胚葉性間充織に由来するが、内臓性骨格の起源は神経冠に由来する外胚葉性間充織であると述べている。頭蓋や顔面を構成する骨組織には神経冠に由来する外胚葉性間充織により形成される骨があることがよく知られているが、外胚葉性間充織に由来する骨を形成する骨芽細胞と椎骨・長管骨などの中胚葉間充織に由来する骨を形成する骨芽細胞の相違は、現時点では明らかにされていない。
2)骨格形成のメカニズム
脊椎動物の初期発生では、中胚葉は原腸形成期に、胚盤葉上層と胚盤葉下層の間に落ち込み側方に移動する細胞群より形成される(図2a,b)。 最近、硬節の形成過程では、脊索および神経管の腹側に位置する底板(floor plate)から分泌される sonic hedgehog(shh) が、重要な役割を担っていることが明らかにされてい(*4,5)る。 | 【図2】ニワトリ胚における中胚葉から体節、さらに硬節、筋節、皮節の形成と発達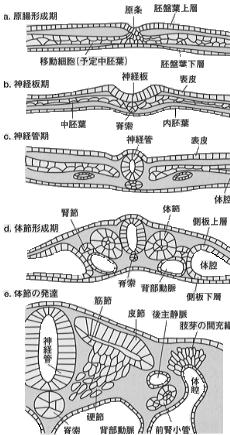 |
体肢骨格に属する四肢の形態形成のメカニズムの解析は、近年、急速に進歩している。特にFGF-4とshhがニワトリ胚肢芽の形態形成の過程で重要な役割を担うことが明らかにされたことは、特筆すべき発見であった(*9,10)。さらに最近、初期ニワトリ胚の体幹部にFGFを過剰発現させると、同部に5つ目の肢芽ができ、これは成長すると足または翼になることが Cohn(*11)と野地らのグループ(*12)からほぼ同時に報告された。このとき、新たに形成された肢芽にはshhの発現も誘導されたことから、肢芽の形成過程ではFGF-4がshhの上流に存在していると考えられる。
、また、四足動物の四肢(前肢と後肢)と魚類の体鰭(胸鰭と腹鰭)は相同と考えられている。両者の大きな違いは四足動物では各肢の末梢に指を含めた末梢骨( autopod )が形成されるが、魚類の鰭にはそれらがないことである。
この点に関して最近、 Sordino ら(*13)は興味ある結果を報告した。彼らはゼブラフィッシュの鰭とマウスの前肢における Hoxd 遺伝子の発現パターンを比較した。鰭および肢芽の形成初期では Hoxd 10-13 が後方部に発現し、鰭の後方部ではshhも発現しており、これらの遺伝子の発現パターンは両者で非常に類似していた。
、しかし、発生が進むと両者で Hoxd 遺伝子の発現に違いがみられた。マウスの肢芽では、肢芽後方部での Hoxd 11 の発現は、肢芽の前方遠心部まで拡大し、同部で指骨の形成が起こるが、魚の鰭では、鰭の形成が進行しても Hoxd 11 の発現は鰭後方部に限局しており、前方遠心部への同遺伝子の拡大は認められなかった。この結果は、鰭、四肢形成の初期の過程は両者で類似しているが、その後の Hoxd 遺伝子の発現パターンの違いが指骨の形成に重要であることを示している。
骨格形成に関与する遺伝子の機能を解析するには、特定遺伝子のノックアウトや骨格の異常を伴う動物の原因遺伝子の解析が非常に有用な手段となる。 Olson ら(*14)は最近、前述した paraxis 遺伝子のノックアウトマウスを作製し、 paraxis 欠損マウスは致死性で、体節に由来する椎骨が欠失していたが、体節に由来しない骨格(頭蓋・顔面など)は形成されていたことを報告した。
、一方 Shawlot ら(*15)はホメオボックス遺伝子である Lim1のノックアウトマウスを作製し、同遺伝子の欠失マウスでは頭部がまったく形成されなかったが、ほかの部の骨格には異常がないことを報告した。 Lim1はニワトリ胚のオーガナイザーである Hensen 結節やマウス初期胚のオーガナイザー部に発現しており、頭部を形成するのに必須の遺伝子と考えられる。骨形成因子( bone morphogenetic protein :BMP)は異所性の骨形成を誘導する因子としてその本体が解析されてきたが、最近ではBMPは骨格を含めた主種の組織の形態形成に重要な役割を担っていると考えられている。
Winnier ら(*16)はBMP-4 のノックアウトマウスを作製した。BMP-4 の欠失マウスは胎生6.5から9.5日で死亡し、種々の表現形質を示した。これらのマウスに共通していたのは、中胚葉組織のマーカーである Brachyury 遺伝子の発現がまったくなく、中胚葉組織がほとんど形成されていないことであった。この結果は、BMP-4 は初期発生に必須の因子で、特に中胚葉の形成に重要な役割を担っていることを示している。
、一方、 Karsenty ら(*17)はBMP-7 (OP-1)のノックアウトマウスを作製した。同マウスは出生後すぐに死亡し、腎臓と目の形成不全を伴い、多指症と助骨の癒合を除くと骨格の形成にはほとんど異常がなかったと報告している。
、また、 Kingsley ら(*18,19)は骨格の異常を呈する short ear マウスと brachypodism マウスの遺伝子の異常を解析し、興味ある結果を報告している。 short ear マウスは耳、助骨、胸骨、脊椎などの正中部に位置する骨格の異常を呈するが、四肢の骨格には異常がない。一方、 brachypodism マウスは四肢の骨格が異常に短いが、正中部の骨格には異常がない。そして、 Kingsley らの解析により、 short ear マウスではBMP-5(*18) の、 brachypodism マウスはBMPファミリーに属するgrowth/differentiation factor(GDF)5(*19)の突然変異が原因遺伝子であることが明らかとなった。
最近、大阪大学医学部の子守らは runt 遺伝子ファミリーに属する転写因子 Cbfa1 のノックアウトマウスを作製し、このマウスは骨芽細胞の分化・成熟抑制のために骨がまったく形成されていないことを明らかにした(*20)。
以上の報告は、骨格の形成は種々のホメオボックス遺伝子やBMPなどによって支配されており、それぞれの骨格の形成は異なる因子で支配されていることを示唆している。