俀丏崪奿宯傪峔惉偡傞嵶朎孮偺暘壔偲偦偺挷愡
丂崪奿偼崪丒擃崪慻怐傪拞怱偵峔惉偝傟偰偄傞偑丄婡擻揑側柺偐傜傒傞偲嬝擏丄崪悜丄銯丄枵懷側偳傕廳梫側崪奿宯偺峔惉梫慺偲峫偊傜傟傞丅傑偨丄崪奿偺宍惉夁掱偱偼丄崪丒擃崪慻怐偼廃埻偺嬝擏丄崪悜娫幙嵶朎乮帀朾嵶朎傪娷傓乯丄枵懷側偳偲枾愙側娭楢傪傕偪側偑傜宍惉偝傟傞丅偦偺偨傔丄崪奿偺宍惉夁掱傪棟夝偡傞偵偼丄崪傪宍惉偡傞崪夎嵶朎偩偗偱側偔丄傎偐偺嵶朎孮偺暘壔夁掱傕棟夝偟偰偍偔偙偲偑廳梫偱偁傞丅
丄傢傟傢傟偼丄偙偺揰偵拝栚偟偰丄庬乆偺攟梴嵶朎傪梡偄偰崪奿宯傪峔惉偡傞崪夎嵶朎丄擃崪嵶朎丄嬝擏丄崪悜娫幙嵶朎側偳偺暘壔偺挷愡婡峔傪専嶕偟丄偙傟傜偺嵶朎宯傊偺暘壔夁掱偱偺崪宍惉場巕乮 Bone morphogenetic protein 丗俛俵俹乯偺栶妱傪夝愅偟偰偒偨丅偙偙偱偼丄傢傟傢傟偺尋媶惉壥傕娷傔偰丄娫梩宯嵶朎偺暘壔夁掱偵偍偗傞俛俵俹偺栶妱傪奣愢偟偨偄丅
侾乯崪宍惉場巕(*21)
丂侾俋俇俆擭丄暷崙偺惍宍奜壢堛 Urist 偼墫巁偱扙奃偟偨崪婎幙傪儔僢僩偺旂壓偵堏怉偡傞偲摨晹偵堎強惈偺崪宍惉偑桿摫偝傟傞偙偲傪柧傜偐偵偟丄侾俋俈侾擭偵偼偙偺傛偆側妶惈傪桳偡傞崪婎幙拞偺抈敀惈場巕傪 Bone morphogenetic protein 乮俛俵俹乯偲柦柤偟偨丅 丂偝傜偵悢庬椶偺堚揱巕慻傒懼偊俛俵俹偑嶌惢偝傟丄偦傟傜偑崪宍惉擻傪桳偡傞偙偲傕帵偝傟偰偍傝丄椪彴墳梡偑婜懸偝傟偰偄傞丅偟偐偟丄堎強惈崪宍惉擻傪巜昗偲偟偰偦偺杮懱偑捛媶偝傟偰偒偨俛俵俹偼丄旂擏側偙偲偵崪慻怐埲奜偺懡偔偺慻怐偱傕敪尰偟偰偍傝丄庬乆偺慻怐傗婍姱偺宍懺宍惉偱廳梫側栶妱傪扴偭偰偄傞偙偲傕柧傜偐偵偝傟偮偮偁傞丅 |
亂恾俁亃尰嵼柧傜偐側俛俵俹偺宯摑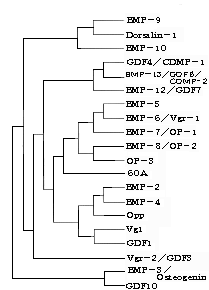 |
嘆娫梩宯嵶朎偺暘壔偵桳梡側攟梴嵶朎
丂崪夎嵶朎丄擃崪嵶朎丄崪悜娫幙嵶朎丄嬝擏偼嫟捠偺枹暘壔側娫梩宯嵶朎乮娫梩宯姴嵶朎偲傕屇偽傟偰偄傞乯偵桼棃偡傞丅 丂枹暘壔側嵶朎偐傜奺乆偺嵶朎宯傊偺暘壔夁掱傪徻嵶偵夝愅偡傞偵偼丄攟梴嵶朎偑桳梡側庤抜偲側傞丅 丂傢傟傢傟偼尰嵼傑偱偵庬乆偺暘壔抜奒偺攟梴嵶朎傪梡偄偰娫梩宯嵶朎偺暘壔夁掱傪夝愅偟偰偒偨乮恾係乯丅 |
亂恾係亃娫梩宯嵶朎偺暘壔夁掱  |
丂傢傟傢傟偑梡偄偰偄傞攟梴嵶朎偺拞偱偄偪偽傫枹暘壔側嵶朎偼 C3H10T1/2 嵶朎偱偁傞丅偙偺嵶朎偼儅僂僗戀帣傛庽棫偝傟偨慄堐夎嵶朎偱丄俢俶俙偺儊僠儖壔傪慾奞偡傞 5-azacytidine 偱張棟偡傞偲嬝擏丄擃崪嵶朎丄帀朾嵶朎傊暘壔偡傞偙偲偑抦傜傟偰偄傞丅
丄傑偨丄傢傟傢傟偑怴惗巈儔僢僩摢奧姤偐傜庽棫偟偨嵶朎姅 ROB-C26(C26) 嵶朎(*23)偼崪夎嵶朎偺昞尰宍幙偺敪尰偑庛偔 丄僐儞僼儖僄儞僩屻偵偼嬝娗嵶朎偑弌尰偟丄僨僉僒儊僞僝儞傪揧壛偡傞偲帀朾嵶朎偑弌尰偡傞丅偦偺偨傔 C26 嵶朎偼崪夎嵶朎丄嬝娗嵶朎丄帀朾嵶朎傊偲暘壔擻傪曐帩偡傞嵶朎偲偟偰桳梡偱偁傞丅 MC3T3-E1 嵶朎偼儅僂僗摢奧崪偐傜庽棫偝傟偨崪夎嵶朎偱偁傞丅
丂杮嵶朎偼杮朚偱庽棫偝傟丄奀奜偱傕峀偔棙梡偝傟偰偄傞崪夎嵶朎條嵶朎偺堦偮偱偁傞丅傑偨丄 ST2 偲 MC3T3-G2/PA6(PA6) 嵶朎偼崪悜娫幙嵶朎桼棃偺慜帀朾嵶朎偱丄憿寣巟帩擻傪桳偡傞嵶朎姅偱偁傞丅堦曽丄 C2C12 嵶朎偲 L16 嵶朎偼嬝夎嵶朎偱丄慜幰偼惉挿儅僂僗偺嬝嵞惗晹偐傜庽棫偝傟偨嵶朎姅偱嬝擏塹惗嵶朎偵桼棃偡傞偲峫偊傜傟偰偍傝丄屻幰偼儔僢僩崪奿嬝桼棃偺嬝夎嵶朎偱塹惗嵶朎偺惈忬偼桳偟偰偄側偄偲峫偊傜傟偰偄傞丅
丂埲忋偺傛偆側嵶朎姅傪梡偄傞偙偲偵傛傝丄枹暘壔側娫梩宯嵶朎偐傜崪夎嵶朎丄擃崪嵶朎丄帀朾嵶朎傪娷傓崪悜娫幙嵶朎丄嬝擏傊偺暘壔夁掱傪 in vitro 偱専嶕偡傞偙偲偑壜擻偲側偭偰偒偨丅
嘇枹暘壔側娫梩宯嵶朎偺暘壔偵媦傏偡俛俵俹偺嶌梡
丂慜弎偟偨傛偆偵 C3H10T1/2 嵶朎傪 5-azacytidine 偱張棟偡傞偲嬝娗嵶朎丄帀朾嵶朎丄擃崪嵶朎偵暘壔偡傞偙偲偑抦傜傟偰偄偨偨傔丄偙偺嵶朎偼偁傞忦審壓偱偼庬乆偺娫梩宯嵶朎偵暘壔偡傞愽嵼擻傪桳偟偰偄傞偲峫偊傜傟偨丅傑偨丄偙偺嵶朎偼捠忢偺攟梴忦審偱偼傾儖僇儕僼僅僗僼傽僞乕僛乮俙俴俹乯妶惈偑旕忢偵掅偔丄暃峛忬態儂儖儌儞乮俹俿俫乯偵懳偡傞墳摎惈偑側偔丄僆僗僥僆僇儖僔儞傕嶻惗偣偢丄崪夎嵶朎偺宍幙傪傎偲傫偳敪尰偟偰偄側偄偨傔丄崪夎嵶朎傊偺暘壔桿摫夁掱傪夝愅偡傞偺偵岲搒崌偱偁偭偨丅
丄偦偺偨傔傢傟傢傟偼傑偢丄 BMP-2 偑 C3H10T1/2 嵶朎偺俙俴俹妶惈偲俹俿俫偵懳偡傞墳摎惈偵偮偄偰専摙偟偨丅偦偺寢壥丄 BMP-2 偼梊憐捠傝偙偺嵶朎偺俙俴俹妶惈偲俹俿俫墳摎惈傪桿摫偟偨(*24)丅傑偨丄 BMP-2 偼 C3H10T1/2 嵶朎偺僆僗僥僆僇儖僔儞偺嶻惗傕桿摫偟偨丅偙傟傜偺寢壥偼 BMP-2 偲 C3H10T1/2 嵶朎傪崪夎嵶朎傊暘壔偝偣傞偙偲傪帵偟偰偄傞丅傑偨 BMP-2 偼杮嵶朎傪崪夎嵶朎傊暘壔偝偣傞偩偗偱側偔丄擃崪嵶朎傗帀朾嵶朎傊傕暘壔偝偣傞丅
嘊崪夎嵶朎偺暘壔偵媦傏偡俛俵俹偺嶌梡
丂傢傟傢傟偺庽棫偟偨 C26 嵶朎偼俙俴俹妶惈偍傛傃俹俿俫偵懳偡傞墳摎惈偑掅偔丄僆僗僥僆僇儖僔儞傕嶻惗偣偢丄枹暘壔側崪夎嵶朎條嵶朎偲峫偊傜傟傞丅偙偺嵶朎偵 BMP-2 傪揧壛偟偰攟梴偡傞偲俙俴俹妶惈偲俹俿俫墳摎惈偑挊柧偵忋徃偟丄僆僗僥僆僇儖僔儞偺嶻惗傕桿摫偝傟偨(*25)丅偙傟傜偺寢壥偼丄 BMP-2 偼枹暘壔側崪夎嵶朎條嵶朎傪傛傝惉弉偟偨崪夎嵶朎傊偲暘壔偝偣傞偙偲傪帵嵈偟偰偄傞丅
丄堦曽丄丅 MC3T3-E1 嵶朎偼丄 C26 嵶朎偲堎側傝傎偐偺嵶朎宯傊偺暘壔擻傪傕偨側偄崪夎嵶朎條嵶朎姅偱偁傞丅 BMP-2 偼偙偺嵶朎偱傕俙俴俹妶惈偲俹俿俫墳摎惈傪挊柧偵懀恑偟丄僆僗僥僆僇儖僔儞偺嶻惗傕桿摫偟偨丅偟偐偟丄 C26 偍傛傃 MC3T3-E1 嵶朎偱偼 BMP-2 傪揧壛偟偰傕 C3H10T1/2 嵶朎偱傒傜傟偨傛偆側柧傜偐側擃崪嵶朎偺弌尰偼擣傔傜傟側偐偭偨丅偙傟傜偺寢壥偐傜丄 BMP-2 偼偡偱偵崪夎嵶朎偺曽岦傊暘壔偑寛掕偟偨嵶朎偺崪夎嵶朎傊偺暘壔傪嫮椡偵懀恑偡傞偑丄擃崪嵶朎偺曽岦傊偲暘壔傪揮姺偝偣傞嶌梡偑側偄偙偲傪帵嵈偟偰偄傞丅
嘋崪悜娫幙嵶朎偺暘壔偵媦傏偡俛俵俹偺嶌梡
丂 ST2 偲 PA6 偼崪悜娫幙嵶朎偵桼棃偡傞嵶朎姅偱丄捠忢偺攟梴忦審偱偼崪夎嵶朎偺宍幙傪傎偲傫偳敪尰偟偰偄側偄丅 ST2 嵶朎偵 BMP-2 傪揧壛偡傞偲丄摨嵶朎偺俙俴俹偑忋徃偟丄俹俿俫庴梕懱偺敪尰偲僆僗僥僆僇儖僔儞偺嶻惗偑桿摫偝傟偨(*26)丅 PA6 嵶朎傕捠忢偺攟梴忦審偱偼 ST2 嵶朎偲摨條偵崪夎嵶朎偺宍幙傪傎偲傫偳敪尰偟偰偍傜偢丄 BMP-2 傪揧壛偡傞偲俙俴俹妶惈偼桿摫偝傟偨偑丄俹俿俫庴梕懱偺敪尰偲僆僗僥僆僇儖僔儞偺嶻惗偼桿摫偝傟側偐偭偨(*26)丅偝傜偵丄 ST2 嵶朎傪 BMP-2 偲偲傕偵 diffusion chamber 撪偵擖傟丄僰乕僪儅僂僗偺暊峯撪偵堏怉偡傞偲 chamber 撪偱柧傜偐側崪慻怐偑宍惉偝傟偨(*26)乮恾係乯丅
丂偙傟傜偺寢壥偼丄崪悜娫幙嵶朎偼 BMP-2 偺嶌梡偵傛傝崪夎嵶朎傊偲暘壔偡傞偑丄偦偺墳摎惈偵偼崪悜娫幙嵶朎偺拞偱懡條惈偑偁傞偙偲傪帵嵈偟偰偄傞丅
嘍帀朾嵶朎偺暘壔偵媦傏偡俛俵俹偺嶌梡
丂 Wang 傜(*27)偼丄慜弎偟偨 C3H10T1/2 嵶朎傪 BMP-2 偱張棟偡傞偲丄偙偺嵶朎偼崪夎嵶朎丄擃崪嵶朎偩偗偱側偔丄帀朾嵶朎傊傕暘壔偡傞偙偲傪曬崘偟偰偄傞丅傑偨丄 Ahren傜 (*28)傕 C3H10T1/2 嵶朎偵 BMP-2 傑偨偼 BMP-4 堚揱巕傪摫擖偡傞偲丄 C3H10T1/2 嵶朎偼崪夎嵶朎傗擃崪嵶朎偩偗偱側偔丄帀朾嵶朎傊傕暘壔偟偨偙偲傪曬崘偟偰偄傞丅傢傟傢傟傕丄 C3H10T1/2 嵶朎傪 BMP-2 偱張棟偡傞偲丄偙偺嵶朎偑帀朾嵶朎傊傕暘壔偡傞偙偲傪妋擣偟偰偄傞丅偙傟傜偺寢壥傪憤崌偡傞偲 BMP-2 偼枹暘壔側慄堐夎嵶朎 C3H10T1/2 傪帀朾嵶朎傊暘壔偝偣傞嶌梡偑偁傞偲峫偊傜傟傞丅
丄堦曽丄 Gimble 傜(*29)偼丄嵟嬤丄 BMP-2 偼崪悜桼棃偺慜帀朾嵶朎偺暘壔傪梷惂偡傞偙偲傪曬崘偟偨丅偙偺寢壥偼丄 C3H10T1/2 嵶朎偵懳偡傞嶌梡偲媡偱丄 BMP-2 偺帀朾嵶朎偺暘壔偵懳偡傞嶌梡偑椉嵶朎娫偱堎側傞棟桼偼柧傜偐偵偝傟偰偄側偄偑丄梡偄傞嵶朎偵傛偭偰 BMP-2 偺嶌梡偑堎側傞壜擻惈偑偁傞丅
丄帀朾嵶朎偼懡偔偺慻怐偵暘晍偟偰偄傞偑丄崪悜桼棃偺帀朾嵶朎偲傎偐偺慻怐偵暘晍偡傞帀朾嵶朎偱偼儂儖儌儞偵懳偡傞墳摎惈偑堎側傞偙偲偑抦傜傟偰偄傞丅旂壓慻怐偺帀朾偵桼棃偡傞慜帀朾嵶朎偼僀儞僔儏儕儞偵傛偭偰帀朾嵶朎傊暘壔偡傞偑丄崪悜桼棃偺嵶朎偼僀儞僔儏儕儞偱偼帀朾嵶朎傊暘壔偣偢偵丄僨僉僒儊僞僝儞側偳偱帀朾嵶朎偵暘壔偡傞丅
丄 C3H10T1/2 嵶朎偼儅僂僗偺弶婜泱偵桼棃偡傞慄堐夎嵶朎偱丄 Gimble 傜(*27)偺梡偄偨嵶朎偼崪悜偵桼棃偡傞慜帀朾嵶朎偱偁傞丅偦偺偨傔丄 BMP 偺帀朾嵶朎偺暘壔偵懳偡傞嶌梡偼崪悜桼棃嵶朎偲傎偐偺慻怐桼棃偺帀朾嵶朎偱堎側傞壜擻惈偑偁傞偺偱丄偝傜偵専摙偑昁梫偱偁傞丅
嘐嬝擏偺暘壔偵媦傏偡俛俵俹偺嶌梡
丂 BMP 傪嬝擏偵堏怉偡傞偲摨晹偱擃崪丒崪慻怐偑宍惉偝傟傞丅偙偺尰徾偼嬝擏撪偵偼丄 BMP 偺嶌梡偵傛傝擃崪嵶朎丄崪夎嵶朎傊暘壔偱偒傞 osteoprogenitor cell 偑懚嵼偟偰偄傞偙偲傪帵偟偰偄傞偩偗偱側偔丄 BMP 偑嬝擏偺暘壔偱傕廳梫側栶妱傪扴偭偰偄傞偙偲傕帵嵈偟偰偄傞丅
丂傢傟傢傟偺庽棫偟偨枹暘壔側崪夎嵶朎條嵶朎偱偁傞偨 C26 嵶朎偼嬝娗嵶朎傊偺暘壔擻傪曐帩偟偰偄傞丅傢傟傢傟偼偙偺嵶朎偺暘壔偵媦傏偡 BMP-2 偺嶌梡傪専摙偟偰偄傞夁掱偱丄 BMP-2 偼 俠俀俇嵶朎偺崪夎嵶朎傊偺暘壔傪懀恑偡傞偩偗偱側偔丄嬝娗嵶朎傊偺暘壔傪梷惂偡傞偙偲傪傒偄偩偟偨(*25)丅
丄俴俇嵶朎偱傕 BMP-2 偵傛傝嬝娗嵶朎偺暘壔傪梷惂偝傟偨偑丄偙偺偲偒俴俇嵶朎偼崪夎嵶朎丒擃崪嵶朎傊偼暘壔偟側偐偭偨乮*25乯丅
丄堦曽丄 BMP-2 偼嬝擏撪偺塹惎嵶朎偵桼棃偡傞偲峫偊傜傟偰偄傞 C2C12 嵶朎偵偍偗傞嬝娗嵶朎傊偺暘壔傪傎傏姰慡偵梷惂偟丄偙偺嵶朎傪崪夎嵶朎傊偲暘壔偝偣傞偙偲偑曅嬎傜乮*30乯偵傛偭偰柧傜偐偵偝傟偨丅
丂 BMP-2 傪揧壛偟側偄偱 C2C12 嵶朎傪攟梴偡傞偲懡悢偺嬝娗嵶朎偑宍惉偝傟丄偙傟傜偺嵶朎偼儈僆僔儞廳嵔傗僩儘億僯儞俿側偳偺嬝擏偵摿堎揑側宍幙傪敪尰偡傞傛偆偵側傞偑丄崪夎嵶朎偺惈忬偼敪尰偟側偄丅
| 丄堦曽丄 C2C12 嵶朎偵 BMP-2 傪揧壛偟偰攟梴偡傞偲丄嬝娗嵶朎偺敪尰偼傎傏姰慡偵梷惂偝傟丄懡悢偺俙俴俹梲惈嵶朎偑弌尰偟偨丅 丄偝傜偵丄 BMP-2 偼 C2C12 嵶朎偺 PTH/PTHrP 庴梕懱偲僆僗僥僆僇儖僔儞偺倣俼俶俙偺敪尰傪桿摫偟偨丅偦偺偨傔 BMP-2 偼嬝夎嵶朎偺暘壔傪梷惂偟丄嬝夎嵶朎偺暘壔偺曽岦傪崪夎嵶朎偺曽岦傊揮姺偝偣傞嶌梡偑偁傞偙偲偑柧傜偐偵側偭偨丅 丄偙偺偲偒丄 BMP-2 偼 C2C12 偵偍偗傞 miogenin, MoyD 偺敪尰傪梷惂偟偰偄偨丅埲忋偺曅嬎傜偺寢壥偼丄 BMP-2 偑嬝擏偺暘壔傪梷惂偟丄偁傞庬偺嬝尨惈嵶朎傪崪夎嵶朎傊暘壔偝偣傞偲偒偵偼丄嬝擏偺暘壔傪寛掕偡傞廳梫側揮幨場巕偱偁傞 MoyD 僼傽儈儕乕偺敪尰傪梷惂偡傞偲偲傕偵丄崪夎嵶朎傊偺暘壔夁掱偱廳梫側揮幨場巕偺敪尰傪桿摫偟偰偄傞壜擻惈傪帵偟偰偄傞丅 |
亂恾俆亃娫梩宯嵶朎偺暘壔偵偍偗傞俛俵俹偺栶妱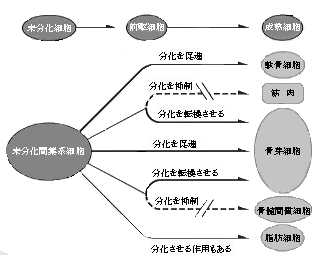 |
偍傢傝偵
丂僀僊儕僗偺挊柧側屆惗暔妛幰 L B Halstead 偼斵偺挊彂 亀The pattern ofvertebrate evolution乮愐捙摦暔偺恑壔條幃乯亁(*28)偺側偐偱師偺傛偆側偙偲傪弎傋偰偄傞丅
丂亀崪慻怐偺敪払偼愐捙摦暔偺恑壔偺夁掱偱廳梫側堄媊傪傕偭偰偄偨丅偙偺偙偲側偟偵偼丄妶摦揑側曗怘幰偵恑壔偡傞偙偲偼側偐偭偨傠偆偟丄傑偟偰棨忋偱偺惗妶傪偼偠傔傞側偳偲偄偆偙偲偼巚偄傕傛傜偸偲偙傠偱偁傞丅愐捙摦暔偺恑壔偵偍偗傞崪慻怐偺廳梫惈偐傜傒偰丄愐捙摦暔偺楌巎偺弶婜抜奒偵崪偑弌尰偟偨梫場傪峫嶡偟偰傒傞偙偲偼柍堄枴偱偼偁傞傑偄亁丅
丂擔偛傠丄壗偘側偔峝偄慻怐偲巚偭偰偄傞崪慻怐偺廳梫惈傪嵞妋擣偝偣偰偔傟傞丅偦偟偰丄尰嵼偺庬乆偺崪幘姵偺惉場傗帯椕朄偵娭偡傞尋媶傪恑傔傞応崌偵傕丄偙偺傛偆側娤揰偐傜崪奿傪峔惉偡傞崪慻怐傪尒捈偡偙偲偼柍堄枴偱偼側偄偩傠偆丅
嶲峫暥專
| (*1) | Romer AS, Parsons TS(暯岝巌栿)丗愐捙摦暔偺偐傜偩亅偦偺斾妑夝朥妛亅丏朄惌戝妛弌斉嬊,pp133-197,1983 |
| (*2) | Mundlos S, Otto F, Mulliken JB, Aysworth AS, Albright S, Lindhout D, Cole WG, Henn W, Knoll JHM,Owen MJ,Mertelsman R, Zable BU, Olsen BR, Mutations involving the transcriptional factor CBFA1 cause cleidocranial dysplasia. Cell 89:773-779,1997 |
| (*3) | Shiang R, Thompson LM,Ya-Zhen Z et al. Mutations in the transmembrame domain of FGFR3 cause the most common genetic from of dwarfism,achondroplasia.Cell78:335-342,1994 |
| (*4) | Johnson RL,Laufer E,Riddle RD, et al. : Ectopic expression of sonic hedgehog alters dorsal-ventral patteming of somites.Cell79:1165-1173,1994 |
| (*5) | Chen-Ming F,Tessier-Lavingne M,Patterming of mammalian somites by surface ectoderm and notochord : Evidence for sclerotome induction by a hedgehog homeolog.Cell79:1175-1186,1994 |
| (*6) | Burgess R,cserfesi P,Ligon KL et al. : A basic helix-loop-helix protein expressed in paraxial mesodem and developing somites.Dev. Biol168:296-306,1995 |
| (*7) | cserjesi P,Brown D,Ligon KL et al. : Scleraxis:a basic helix-loop-helix protein that prefigures skeletal formation during mouse embryogenesis.Development121:1099-1110,1995 |
| (*8) | Blanar MA,Crossley PH,Peters KG et al. : Meso1,a basic helix-loop-helix protein involved in mammalian presomitic mesoderm development.Proc,Natl Acad Sci USA92:5870-5874,1995 |
| (*9) | Niwander L,Tickle C,Vogel A et al. : FGF-4 replaces the apical ectodermal ridge and directs limb outgrowth and patterning of the limb.Cell75:579-578,1993 |
| (*10) | Riddle RD,Johnson RL,Lauter E et al. : Sonic hedgehog mediates the polarizing activity of the ZPA.Cell75:1401-1416,1993 |
| (*11) | Cohn MJ,Izpisua-Belmonte JC,Abud H et al. : Fibroblast growth factors induce additional limb development frm the frunk of chick embrtos.Cell80:739-736,1995 |
| (*12) | Ohuchi H,Nakagawa T,Yamauchi M et al. : An additionallimb can be induced from the flank of the chick embryo by FGF-4.Biophys Res Commun209:809-816,1995 |
| (*13) | Sordino P,van der Hoeven F,Duboule D: Hox gene expression in teleost fins and the origin of vertebrate digits.Nature375:687-681,1995 |
| (*14) | Olson EN : Helix-loop-helix protein in chondrogenic cell lineages. Abstracts in Molecular and Developmental Biology of Cartilage,1995 |
| (*15) | Shawlot W,Behringer RR,Requirement for Lim 1 in head-organizer function.Nature374:425-430,1995 |
| (*16) | Winnier G,Blessing M,Labosky PA et al. : Bone morphogenetic protein-4 is required formation and patterning in the mouse.Gene Dev9:2105-2116,1995 |
| (*17) | Karsenty G : BMP-7 is an inducer of nephrogenesis, and is required for eye dwvelopment and skeletal patterning. Abstracts in Molecular and Developmental Biology of Cartilage,1995 |
| (*18) | Kingsley DM,Bland AE,Grubber JM et al. : THe mouse short ear skeletal morphogenesis locus is associated with defects in a bone morphogenetic member of the TGFb superfamily.Cell71:399-410,1992 |
| (*19) | Storm EE,HUynh TV,Copeland NG et al. : Limb alterations in brachypodism mice due to mutations in a newmember of the TGFb^superfamily.Nature368:639-643,1994 |
| (*20) | Kmori T,yAgi H,Nomura S et al. : Targeted disruption of Cbfa1 results in complete lack of bone formation owing to the maturation arrest of osteoblasts.Cell89:755-764,1997 |
| (*21) | 嶳岥丂楴 : BMP 尋媶偺楌巎揑曄慗.The Bone7:29-38,1993 |
| (*22) | Yamaguchi A : Regulation of differentiation pathway of skeletal mesenchymal cell lines by transforming growth factor-b superfamily.Seminors in Cell Biol6:165-173,1995 |
| (*23) | >Yamaguchi A,kahn AJ : Clonal osteogenenic cell lines express myogenic and adipocytic developmental potential.>calcif Tissue Int49:221-225,1991 |
| (*24) | Katagiri T,Yamaguchi A,Ikeda T et al. * The non-osteogenic mouse pluripotent cell line.C3H10T1/2,is induced to differentiate into osteoblastic cells by recombinant human bone morphogenetic protein-2.BiophysBiochem Res Commun 172:295-299,1990 |
| (*25) | Yamaguchi A,Katagiri T,Ikeda T et al. Recombinant human bone morphogenetic protein-2 stimulates osteoblastic maturation and inhibits myogenic ifferentiation in vitro.J Cell Bial113:681-687,1991 |
| (*26) | Yamaguchi A,Ishizuya T,kintou N et al. : Effects of BMP-2,4 and -6 on osteoblastic differentiatin of bone marrow derived stromal cell lines,ST2 and MC3T3-G2/PA6.Biophs Res Commum220:366-371,1996 |
| (*27) | Wang EA,Israel DI,Kelly S et al. : Bone morphogenetic protein-2 causes commitment and differentiation in CH310T1/2 and 3T3 cells.Growth Factor9:57-71,1993 |
| (*28) | Ahrens M,Ankenbauer T,Schroder D et al. : Expression of human bone morphogenetic proteins-2 or-4 in murine mesenchymal progenitor C3H10T1/2 cells induces differentiation into distinct mesenchymal cell lineages.DNA and Cell Biol12:871-880,1993 |