6.破骨細胞の分化および活性の制御について
破骨細胞は造血幹細胞に由来し、IL-3,granulocyte-macrophage colony-stimulating factor,macrophage colony-stimulating factor(M-CSF),1,25(OH)2D3などの作用により monocyte-macrophage 系の細胞から分化すると考えられている(*63)。
、このようにして分化した破骨細胞の前駆細胞は、単核の前破骨細胞となり骨表面に引き寄せられて定着し、多核化し破骨細胞へと分化する。前破骨細胞の分化や骨表面への誘導に重要な役割を果たしているのは、その周囲を取り囲んでいる骨芽細胞系の間葉細胞であり、破骨細胞の単核前駆細胞はそれらの細胞と互いに接触しながら情報交換を行い分化を進めると考えられている。特に Suda, Takahashi らは1,25(OH)2D3添加培地で骨髄細胞あるいは脾細胞が破骨細胞に分化する過程には骨芽細胞系細胞の存在が必要であり、しかも互いに直接接触することが必須であることを明らかにしている(*64~67)。破骨細胞の分化に直接・間接的に関与する物質としては、1,25(OH)2D3のほかに PTH,calcitonin,PGs,M-CSF,interferon-γ,tumor necrosis factor-β,IL-1,IL-6,IL-11,bisphophonate などがあげられている。
例えば、M-CSF欠乏による op/op マウスは破骨細胞と macrophage が存在しないが、recombinant M-CSF の投与により破骨細胞が劇的に増加し骨吸収が開始することから、破骨細胞の分化に対して間質系細胞由来の M-CSF が必須であることが明確にされており(*68)、免疫細胞化学的にも間質細胞における M-CSF の局在が明らかにされている。
さらに近年、破骨細胞の分化形成に関する注目すべき因子として破骨細胞分化誘導因子( osteoclast differentiation factor : ODF )が発見された(*69)。 ODF は骨組織の骨芽細胞系細胞から産生されており、 ODF 受容体を有する破骨細胞前駆細胞との細胞間相互作用により破骨細胞の分化形成を誘導すると考えられている。
一方、破骨細胞形成抑制因子(*70)( osteoclastogenesis inhibitory factor : OCIF )またはステオプロテジェリン( osteoprotegerin : OPG )は、骨組織をはじめほかの組織からも産生・分泌されており、破骨細胞の分化形成を抑制する因子として報告されている。
、 ODF および OCIF が破骨細胞形成に対する作用機序としては、OCIF/OPG は骨芽細胞系細胞の膜表面に存在する ODF と破骨細胞前駆細胞の ODF 受容体との結合を競合的に抑制し、前駆細胞に対する ODF の signalling を抑制していると考えられる。
一方、c-fos と破骨細胞形成との関連も論じられており、c-fos 遺伝子欠損マウスでは、破骨細胞が存在しないにもかかわらず macrophage の形成は認められることから、c-fos は monocyte-macrophage 系から最終的に破骨細胞へと分化させる重要な因子であることが考えられる。
、さらに monocyte 系および Bcell に特異的な転写因子である PU.1 の遺伝子発現が破骨細胞に認められ、その分化に伴って増加すること、さらに PU.1 欠損マウスでは macrophage および破骨細胞は存在せず骨吸収が行われないため osteopetrosis を呈することが報告されている(*71)。 PU.1 欠損マウスは、c-fos 欠損と同様に破骨細胞の前駆細胞の遺伝子的障害に由来しているが、c-fos 欠損マウスでは多数の macrophage が存在することから、c-fos は破骨細胞の分化において遅い段階で機能すると考えらる。
、また、c-src 遺伝子欠損マウスは骨吸収不全により大理石骨病が引き起こされることが知られていたが、Horne らにより正常な破骨細胞は c-src 遺伝子蛋白であるチロシンキナーゼ活性を有する pp60c-srcが細胞内の小胞に結合して局在していることが明らかにされた(*72)。
、また、Boyce らは pp60c-srcは細胞骨格系蛋白をリン酸化することにより、波状縁の形成に重要な役割を担う可能性を述べている(*73)。
|
臨床的に破骨細胞を抑制する物質としては calcitonin が最もよく知られており、 calcitonin レセプターは大量に破骨細胞に存在している。骨吸収を活発に行っている破骨細胞に calcitonin を作用させると、これら細胞の細胞質突起および細胞内小胞や空胞の停滞、さらには波状縁の平坦化と骨面からの離脱が観察されている(*74)。 これら一連の変化は、dibutyryl cAMP,cytocalacin の添加や細胞内 Ca2+ 濃度を上昇させることによっても生ずることから、細胞内の cAMP や Ca2+などの second messenger を介した細胞骨格の動的変化が破骨細胞の骨吸収機能をコントロールしていることが推測される。 |
【 骨芽細胞の機能と調節因子の概略図 】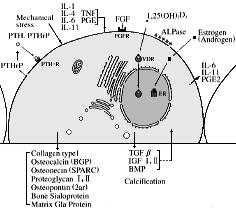
|
、さらにレセプターと結合した calcitonin が細胞膜からゴルジ体にまで輸送されること、また calcitonin により calcitonin レセプター mRNA の down-regulation が起こることが報告されている。
、なお、発育成長中の長管骨においては、epiphysis の骨端板軟骨部において calcitonin gene-related peptide ( CGRP )陽性の神経線維の終末部が破骨細胞に接する像が観察されている。この部位では多数の破骨細胞が存在するにも関わらず骨吸収は低く、おそらく CGRP が calcitonin レセプターに結合するために破骨細胞の機能抑制を神経性に行っている可能性が推測される(*76)。
近年、注目されてきた破骨細胞抑制因子として bisphosphonate をあげることができる(*77)。 bisphosphonate は悪性腫瘍による高カルシウム血症( HHM : humoral hypercalcemia of malignancy )あるいは LOH ( local osteolytic hypercalcemia )、骨Paget病、骨粗鬆症の治療として臨床応用されている(*78~80)。
、 bisphosphonate の骨吸収抑制作用の機序については、一般的に bisphosphonate が骨基質に沈着して破骨細胞に取り込まれることにより、破骨細胞にアポトーシスを誘導させる考え方が主流を占めている。その形態変化として、破骨細胞は bisphosphonate を取り込むと、波状縁が消失するとともに骨基質から離れ極性を失う。
、そのような破骨細胞には細胞内小器官であるゴルジ体の消失、巨大化したミトコンドリアの出現、空胞や小胞の貯留が認められるほか、アポトーシスの典型像であるヘテロクロマチンの凝集が観察される。
、このような破骨細胞を TUNEL 法により断片化した DNA を調べてみると、その核に一致した陽性反応が確認される。これらの破骨細胞はさらに細胞内小器官の崩壊と細胞全体の縮小化を示しながら分断化されていき、最終的には macrophage などによって処理されることがわかっている(*81)。
近年、腫瘍性骨吸収においても、その主役は破骨細胞であることが明らかになりつつあり、骨転移した腫瘍組織内には破骨細胞の分化過程も観察され、腫瘍細胞や腫瘍の間質系細胞から分泌される各種サイトカインの破骨細胞の分化・活性化に果たす役割なども論じられている。
最後に、破骨細胞にライアノジンレセプターばかりでなく、前述の calcium sensing receptor の存在が指摘されはじめており、もしそうであれば、破骨細胞も骨細胞と同様に、細胞外カルシウム濃度を認識しながら骨吸収を営む細胞であることが推測される。
3.骨芽細胞、骨細胞の機能を調節する因子:カルシウム調節因子